化合物筛选是高通量筛选的主要也是基本用途,这种用途一般会结合前期机制研究 (如生信分析,基因组学或蛋白组学等进行靶点鉴定),针对鉴定的靶点筛选相应抑制剂或激动剂,这种筛选模式我们称为基于靶点的筛选 (target-based screening);此外,也可基于当前研究疾病,直接构建相应疾病模型,再利用高通量筛选技术,筛选针对某种疾病表型的化合物,这种筛选模式我们称为基于表型的筛选 (Phenotypic -based screening)[1]。不管基于哪种筛选模式,最终目的是为了找到能够对某种疾病具有治疗价值的小分子化合物。上实例
纤维性疾病几乎影响到身体的每一个组织,这种疾病的发生发展会迅速导致器官功能障碍、器官衰竭,最终导致死亡。成纤维细胞诱导细胞外基质 (ECM) 的大量沉积 (I 和 V 型胶原作为标志物) 是纤维化疾病的标志。 目前临床可供使用的抗纤维化的药物相对缺乏。2021 年,由 MichaelGerckens 等人开发了一种基于表型筛选开发新型抗纤维化药物的方法,并鉴定出一系列具有较高活性的抗纤维化化合物[2]。
■ 筛选模型建立
首先作者建立了一种深度学习模型 (deep learning model),可以对高通量显微成像获得的数千张细胞外基质 (ECM) 免疫染色图片进行批量分析,以确定具有改善纤维化状态的先导化合物。
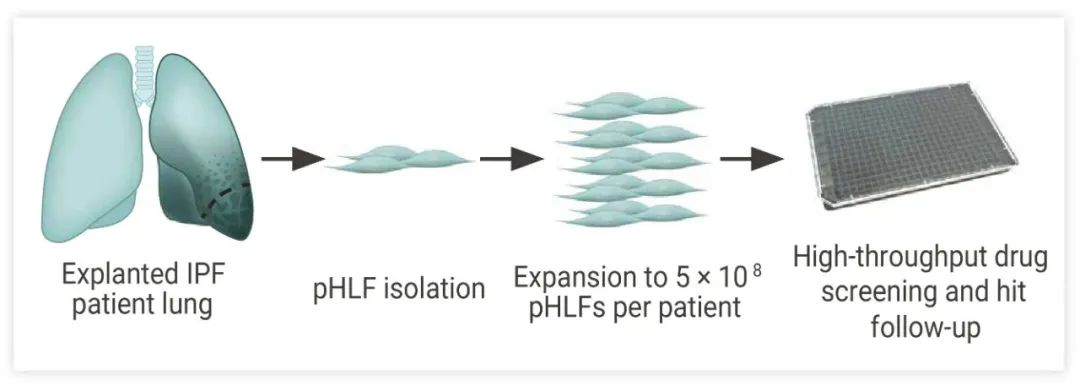
图 1. 提取自特发性肺纤维化患者的人原代肺纤维化细胞,在培养基中生长,用于高通量筛选模型[2]
■ 高通量筛选
在 100 μM 浓度下,使用MCE FDA 批准上市库进行筛选,通过显微成像技术,最终得到 16 种阳性化合物 (图 2a) 中,其中 Tranilast 在抑制基质沉积方面表现出良好的效果,并呈现出剂量依赖性 (图 2b) ,并且已有文献表明 Tranilast 在体内具有较好的生物利用度、安全性和耐受性的安全性,最终选定 Tranilast 作为先导化合物。

图 2. 先导化合物的确认[2]
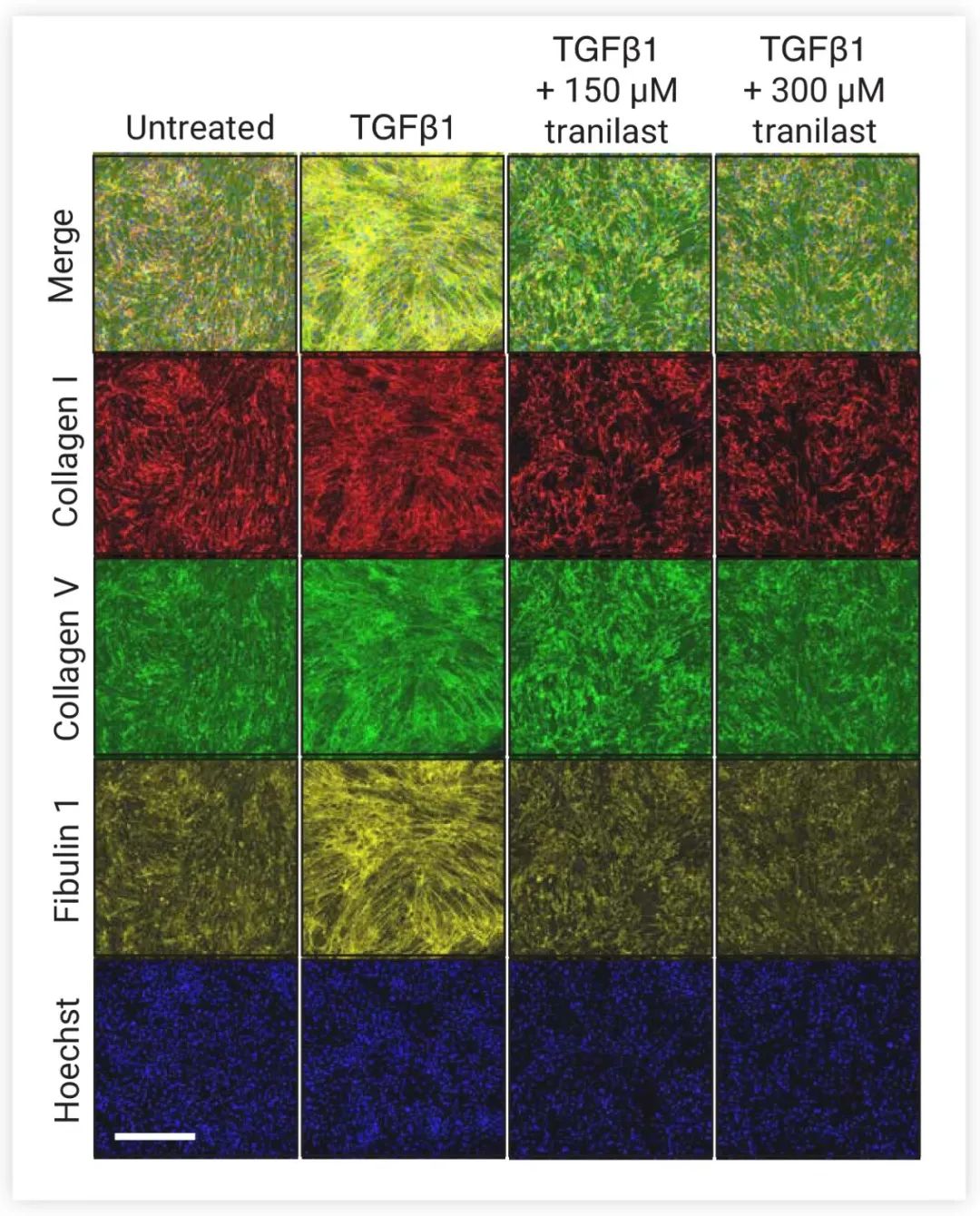
图 3.Tranilast 对 ECM 沉积表现出浓度依赖的抑制作用[2]
■ 构效关系分析及先导化合物优化
由于筛选到的 Tranilast 需要在较高浓度 (>150 μM) 下才会表现出较强的抗纤维化活性,所以作者还对 Tranilast 做了进一步结构优化,希望从 Tranilast 结构类似物中筛选到具有更高活性的产品 (图 4a)。通过对Tranilast结构类似物及合成的一系列结构类似物做进一步筛选,得到一系列 N-(2-butoxyphenyl)-3-(phenyl)acrylamides (N23Ps),部分 N23Ps 具有较高的抗纤维化活性,抑制 ECM 沉积的 IC50 数值在 10 μM 以下 (图 4b)。
图 4. Tranilast 及 N23Ps 结构[2]
■ N23Ps 作用机制研究
基上述活性筛选,作者团队进一步进行了机制验证;他们对纤维化组,纤维化+ N23Ps 组 (给药组) 及空白组进行芯片转录组分析,发现一系列蛋白表达调控差异。通过对组学数据分析及基因功能关系分析,鉴定出 E3 连接酶 SMURF2 (TGFβ1 信号通路中重要的胞内信号因子) 可能参与了 N23Ps 对抗纤维化的调控。
图 5. 通过转录组分析及基因功能关系分析探究 N23Ps 作用机制[2]
为了深入了解 N23P 调节 TGFβ1 依赖性肌成纤维细胞转分化的机制,使用 SMURF2 siRNA 敲低进行了功能丢失研究。cmp4 处理显著抑制 TGFβ1 处理的 IPF-phLFs 中 αSMA 蛋白的表达; 但这种抑制在 SMURF2 缺失的 phLFs+TGFβ1+cmp4 的肌成纤维细胞中被阻止 (图 6),这表明 N23Ps 确实会通过 SMURF2 抑制的 TGF-β 通路参与抗纤维化调控。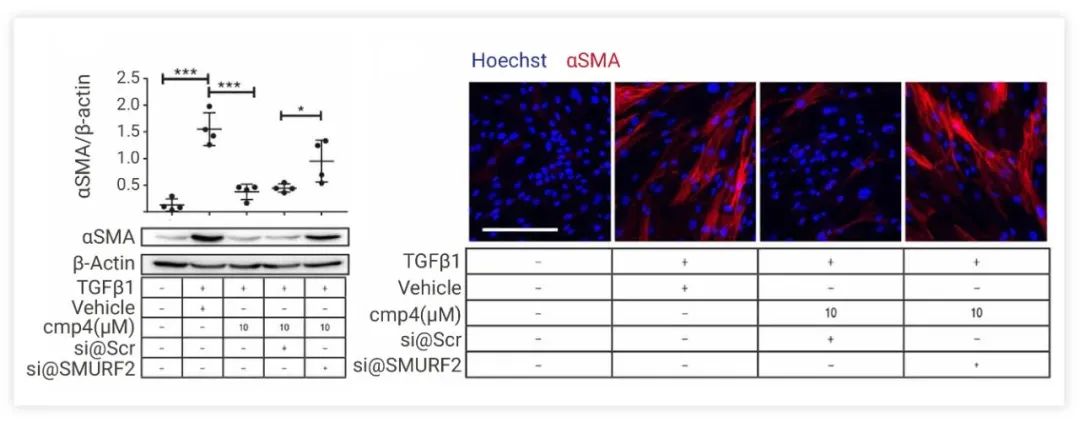
图 6. N23Ps 可能的作用机制通路[2]
除了上述应用,活性化合物库由于具有明确的靶点及作用机制,常被用来进行机制研究。通过高通量筛选对得到的先导化合物进行靶点及作用机制的聚类分析,可以推测哪些靶点或通路可能参与了疾病调控,通过进一步验证,可以揭示一些新的作用机制或靶点。一次筛选,相当于指明了后续研究方向。下面我们通过一篇 Claudia Capparelli 等科学家今年发表在 Nature Communications 上的文章为例看一下如何利用高通量筛选技术进行机制探究的[3]。
■ 研究背景
SOX10 是黑色素瘤细胞中异质性表达的一种转录因子,SOX10 的缺失会降低细胞增殖,导致侵袭性,并促进对 BRAF 和/或 MEK 抑制剂的耐受性。为了解决药物耐受问题,寻找能诱导 SOX10 缺陷细胞死亡的药物,Claudia Capparelli 等人对 MCE 抗肿瘤化合物库进行筛选。■ 筛选模型建立
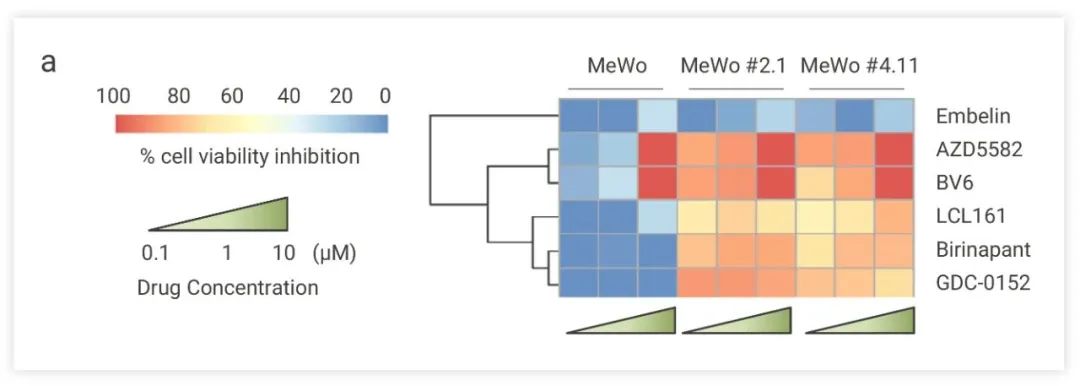 图 7. cIAP1/2-XIAP 抑制剂对 SOX10 缺陷细胞表现出细胞生长抑制活性[3]
图 7. cIAP1/2-XIAP 抑制剂对 SOX10 缺陷细胞表现出细胞生长抑制活性[3] ■ 机制探究
紧接着,为了验证上述推测,进行了蛋白表达分析及基因组学分析,结果表明 cIAP2 表达与 SOX10 表达成负相关,cIAP2 参与诱导 SOX101 缺陷细胞死亡 (图 8),并找到了治疗 RAF 和/或 MEK 抑制剂耐药性的有效方案,即在 BRAFi 和 MEKi 方案中加入 cIAP1/2 抑制剂将延迟获得性耐药的发生。

图 8. SOX10 缺失在黑色素瘤中的调控机制[3]
对于机制或表型复杂的疾病,筛选之前开发合适的筛选模型是实验的重中之重,化合物库可以用于新开发筛选模型的验证。如 Jong-ChanPark 等科学家报道的一个基于信号网络的高效阿尔茨海默病 (AD) 药物筛选平台,提出了数学建模和人类 iCO相结合的精准医疗策略[4]。
为了建立该平台,作者团队进行了三个步骤:(i) 从 AD 参与者中生成 iPSC 衍生的类器官 (iCO) (源于 11 名参与者的 1300 个类器官被用于药物评估平台)。(ii) 通过对神经元分子调控网络的分析,提出了考虑神经元动态的分子调控网络数学模型,进行了基于系统生物学的AD路径数学模拟 (包含信令网络构建、网络模型验证、控制节点识别等步骤)。(iii)利用该筛选平台对MCEFDA库中的可透过血脑屏障化合物进行筛选,并通过高内涵筛选 (HCS) 成像系统定量 AD 发病程度, 验证了所建立的筛选模型的可行性,并得到一系列在 AD 治疗方面具有潜在应用价值的药物。
高通量筛选技术已经不再是制药领域的专属工具,它已经逐渐成为科研领域进行基础研究的重要工具。除了先导化合物的筛选,化合物新功能探究及疾病机制的研究等,对于某些机制或表型复杂的疾病,运用高通量筛选技术先建立合适的筛选模型是实验的重中之重。相信高通量筛选技术将为学术机构在这方面研究发挥越来越大的推动作用。
|
相关产品 |
|
MCE收录了15000+ 种具有明确报道的、活性已知、靶点明确的小分子化合物,包括天然产物,新型化合物,已上市化合物及处于临床期化合物等,可以用于信号通路研究,新药研发,老药新用等不同的筛选目的。 |
|
MCE收录了2600+ 个批准上市的化合物,这些化合物已经完成了广泛的临床前和临床研究,具有良好的生物活性、安全性和生物利用度。 |
|
MCE收录了 3700+ 种天然产物,包括糖类和糖苷,苯丙素类,醌类,黄酮类,萜类,类固醇,生物碱,酚类,酸和醛等,天然产物化合物库是一种有用的药物开发工具。 |
|
MCE可以提供 17000+ 种片段化合物,这些化合物均符合“类药 3 原则 (RO3)”,MCE 片段化合物库是先导化合物的重要来源。 |
|
MCE 老药新用化合物库包括 4000+ 种批准上市药物及临床Ⅰ期以后化合物,这些化合物已经完成了广泛的临床前和临床研究,具有良好的生物活性、安全性和生物利用度,特别适合药物新适应症的研究。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献
[1] Wei Zheng, etc. Phenotypic screens as a renewed approach for drug discovery. Drug Discov Today. 2013 Nov;18(21-22):1067-73.[2] Michael Gerckens, etc. Phenotypic drug screening in a human fibrosis model identified a novel class of antifibrotic therapeutics. Sci Adv. 2021 Dec 24;7(52):eabb3673.
[3] Claudia Capparelli, etc. Targeting SOX10-deficient cells to reduce the dormant-invasive phenotype state in melanoma. Nat Commun. 2022 Mar 16;13(1):1381.
[4] Jong-Chan Park, etc. A logical network-based drug-screening platform for Alzheimer's disease representing pathological features of human brain organoids. Nat Commun. 2021 Jan 12;12(1):280.

