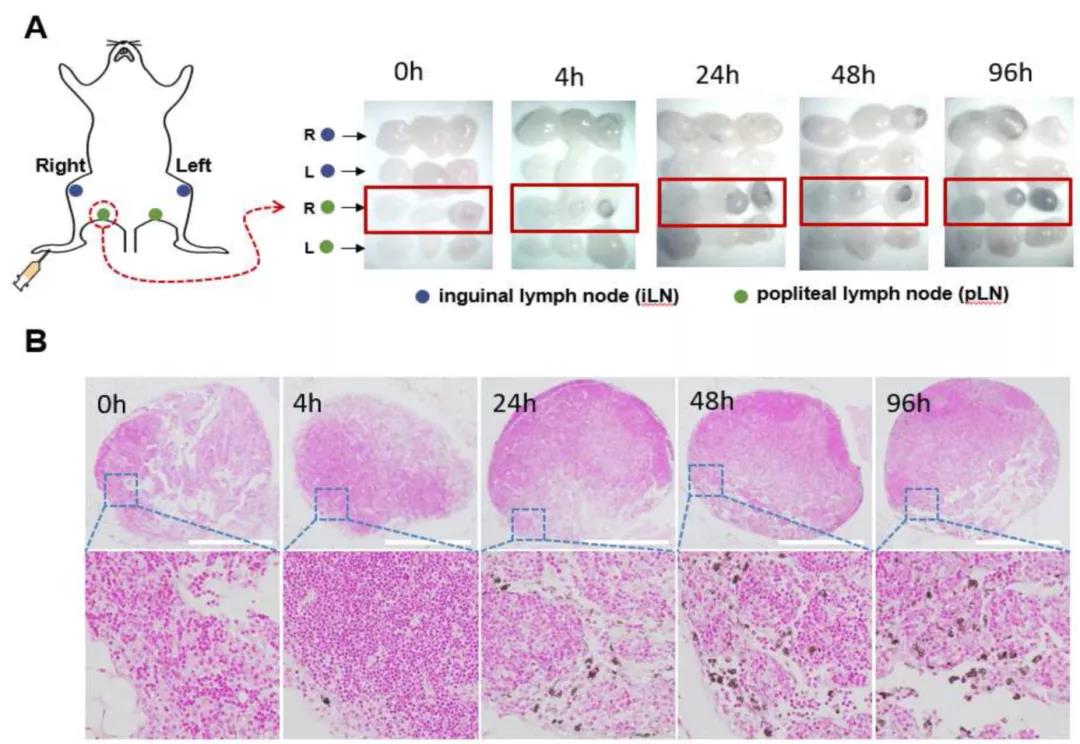
淋巴结(LNs)是免疫系统的重要组织,淋巴结内含有重要的免疫细胞如DCs和T细胞。因此将药物直接送到淋巴结可以很大程度的提高其生物利用度和减少副作用。然而,小分子免疫调节剂的生物药剂学特性通常导致淋巴吸收不良。已经发现,皮下注射后,纳米颗粒将由于内皮细胞通透性的固有间隙,优先流入淋巴管而不是毛细血管。基于这一观点,各种纳米载体,已被用于靶向淋巴传递。研究还发现,纳米颗粒的淋巴引流能力很大程度上取决于其颗粒直径的大小和表面性质。一般来说,增加颗粒大小可以增强淋巴结滞留时间,但是会阻碍颗粒从注射部位的引流过程。类似的,可以通过修饰掩盖纳米颗粒与基质的静电作用来改善纳米颗粒的淋巴引流。然而,这也可能抑制他们的淋巴结滞留。因此,淋巴结靶向纳米材料的设计应该注重如何平衡快速淋巴引流与最佳淋巴结滞留时间之间的关系。 聚多巴胺(PDA)是多巴胺的聚合形式,是一种存在于大脑中典型的神经递质。由于其独特的特性,如内在的生物相容性、强黏附性和强近红外光吸收,各种基于PDA的材料已经在生物医药领域被开发应用。PDA纳米粒子(PDA NPs)可以方便的合成,并表现出在结构上负载具有芳香环化合物的能力,如通过π-π堆积和/或疏水相互作用负载阿霉素(DOX)。如果颗粒内刻上介孔,这种载药能力可进一步提高,如介孔聚多巴胺纳米颗粒(MPDA NPs)。此外,PDA NPs的高光热转化效率(约40%)保证了用于光热疗法的可行性,通过该性能,不仅可以直接破坏肿瘤细胞,还可以同时释放肿瘤抗原,从而增强肿瘤组织的免疫原性。迄今为止,很少有关于MAPD NPs作为纳米载体用于靶向淋巴给药的应用证实。 Figure 1 重庆大学蔡开勇课题组以TLR 7激动剂咪喹莫特(R837)为免疫调节模型,设计并应用基于MPDA的药物给药系统进行靶向淋巴免疫激活(Fig.1)。将R837高效的负载到MAPD NPs上,并将生物相容性聚合物聚乙烯吡咯烷酮(PVP)通过PVP上的羰基与MPDA NPs上的酚羟基之间的氢键相互作用用于表面涂层。所设计的PVP-MPDA@R837纳米佐剂与游离R837相比,纳米佐剂有明显优势能促进树突细胞(DCs)成熟,而且有在近端淋巴结中转运和滞留的能力,可以在很大程度上使淋巴药物暴露最大化,并且结合了MPDA的光热转化特性和淋巴聚焦免疫激活,具有很强的抗黑色素瘤的能力。 基本信息 题目: Lymph node-targeted immune-activation mediated by imiquimod-loaded mesoporous polydopamine based-nanocarriers 期刊:Biomaterials 影响因子:10.27 PMID:32569862 作者: 重庆大学王璐为论文第一作者 蔡开勇为论文唯一通讯作者 作者单位:重庆大学 索莱宝合作产品: 产品名称 产品货号 Mouse IL-6 ELISA KIT Mouse IL-12p 40 ELISA KIT Mouse TNF-α ELISA KIT 摘 要 Toll样受体(TLR)激动剂是先天免疫系统的强效兴奋剂,有望作为抗癌免疫疗法的佐剂。不幸的是,它们中的大多数都受到了迅速传播的限制,从而导致了“浪费的炎症”。因此,如何将它们的作用半径限制在淋巴组织中,对于提高疗效并同时减轻副作用具有重要意义。本实验中,将TLR 7激动剂咪喹莫特(R837)高效负载到介孔聚多巴胺(MPDA)纳米载体中,并用聚乙烯吡咯烷酮(PVP)对其表面进行改性,以增强其淋巴引流能力。与游离R837相比,这些纳米佐剂在促进树突细胞成熟方面具有明显优势。此外,它们在近端淋巴结(LNs)中的转运和滞留能力也得到证实,通过这种转运和滞留能力,可以在很大程度上使淋巴药物暴露最大化。因此,通过引流淋巴结释放的R837,观察到有效的DCs激活和CD8+T细胞反应。基于MPDA的光热效应诱导的凋亡碎片中内源性肿瘤抗原的存在进一步增强了这种效应,并因此导致皮下B16黑色素瘤的生长抑制。结果表明,所设计的PVP-MPDA@R837纳米佐剂结合了MPDA的光热转化特性和淋巴聚焦免疫激活,具有很强的抗黑色素瘤的能力。 研究内容及结果 1、PVP-MPDA NPs的制备与表征 采用文献报道的方法合成了MPDA NPs(介孔聚多巴胺纳米粒子)。以普朗尼克F127和1,3,5-三甲苯(TMB)为有机样本,乙醇和TRIS作为助溶剂和催化剂。聚合后通过去除模板得到颗粒。然后通过氢键将亲水聚合物PVP(聚乙烯吡咯烷酮)包覆在MPDA NPs上,以提高其在PBS中的稳定性,防止载药提前泄漏。透射电子显微镜(TEM)图像(Fig.2A)显示MPDA NPs具有轮廓分明的中心辐射孔结构的球形形态。经过表面改性后,介孔结构被粒子周围的PVP层所掩盖。纳米颗粒在水溶液中的水动力尺寸和Zeta电位如Fig.2B所示。动态光散射(DLS)测量结果显示,MPDA和PVP-MPDA NPs的尺寸分别约为164.2nm和190.1nm。PVP-MPDA NPs的表面zeta电位小于MPDA(-3.54±0.27 vs -11.83±0.15mV)。此外,亲水性PVP的表面修饰使颗粒在水溶液中更加稳定(Fig.S1)。 Figure 2 经近红外照明(808nm,0.5W/cm2)的方法对PVP-MPDA NPs的光热转换性能进行了评价。如Fig.2C所示,PVP-MPDA溶液的光热转换明显依赖于粒子浓度。近红外曝光后,PVP-MPDA溶液(500μg/mL)的温度在300s内从21.4℃升高到33.8℃,而水的温度仅升高1.8℃。采用前面方法计算,结果得出PVP-MPDA和MDA NPs的光热转换效率(η)分别为38.71%(Fig.2D)和39.51%(Fig.S2)。这意味着表面覆盖PVP后,MPDA NPs的光热转换性能几乎没有变化。 2、PVP-MPDA NPs中R837的加载和释放 据报道,MPDA NPs可以将具有典型芳香族分子结构的药物或染料,如DOX或Rhodamine B,通过π-π堆积和疏水相互作用物理吸收加载到多孔结构中。根据其化学结构,我们假设R837可以被有效地吸附到MPDA NPs中。将R837与给定数量的MPDA溶液混合,得到不同初始药物浓度(0-500μg/mL)的吸附等温线。收集并分析得到的MPDA@R837溶液。如Fig.3A所示,MPDA的吸附量随着R837浓度升高而逐渐增加,当初始药物浓度大于400μg/mL时,达到饱和状态。因此,以500μg/mL的R837加样浓度制备了载药率为400μg/ mL(WR837/WMPDA)的PVP-MPDA@R837 NPs,用于后续实验。 PVP-MPDA@R837表现出酸性pH应答型药物释放模式(Fig.3B)。在第一个小时中,在pH5.0(模拟内体/溶酶体的pH值)下释放了约18.69%的封装R837,在24小时内约48.47%。但是,当pH值为7.4时,在开始的1小时内仅释放2.12%,随后在24小时内缓慢释放(约9.34%)。这种现象可能归因于溶液中R837的溶解量对pH的依赖性。由于氨基的质子化增加,R837在酸性条件下表现出较高的水溶性。 Figure 3 3、PVP-MPDA NPs体外细胞毒性 考虑到PVP-MPDA NPs在给药中的应用,评估其生物相容性是至关重要的。MTT法显示(Fig.3C),剂量达175μg/mL PVP-MPDA NPs的对B16F10细胞几乎无毒(细胞活力>80%)。这一结果与之前的报告一致,即PDA本身没有毒性。而在808nm激光照射(0.5W/cm2持续5分钟)后,细胞存活率以浓度依赖方式明显下降。当PVP-MPDA NPs的浓度为18μg/mL时,约有50%的细胞存活。然而,当浓度升高至175μg/mL时,仅检测到21.2%的活细胞,说明PVP-MPDA可以通过光热效应有效杀死肿瘤细胞。虽然R837一直以其在诱导DCs成熟过程中的显著作用而闻名,但它可以部分杀伤肿瘤细胞。通过将B16F10细胞与R837,PVP-MPDA@R837在有/没有近红外光暴露的条件下孵育来进行细胞的活力测定(Fig.3D)。结果表明,PVP-MPDA@R837组细胞存活率普遍随药物浓度的升高而降低。这与等量的游离R837相比略低,可能是由于纳米载体延迟了药物的扩散。值得注意的是,在近红外照射下,由于光热诱导的细胞杀伤效应,PVP-MPDA@R837组细胞活力明显增强。这些数据表明,R837除了具有免疫刺激DCs的主要功能外,还可直接诱导肿瘤细胞死亡,这将在一定程度上提高免疫治疗的总体抗肿瘤性能。 4、PVP-MPDA@R837对BMDCs体外活化的研究 树突状细胞是最强大的抗原提呈细胞。未成熟DCs的激活对活化初始幼稚型T细胞至关重要,并且能引发T细胞介导的免疫应答。DCs的成熟通常伴随着协同刺激分子的上调表达和促炎细胞因子的分泌。在实验中,通过使用流式细胞仪来测定BMDC表面共刺激分子(CD80和CD86)的表达水平,研究PVP-MPDA@R837 NPs的免疫刺激活性。添加PVP-MPDA@R837后,共刺激因子的表达水平明显上调,表达水平与等量游离R837处理相似,而PVP-MPDA处理与PBS对照之间无明显差异(Fig.4)此外,通过ELISA检测促炎细胞因子的释放,包括TNF-α(一种激活细胞免疫的关键标志物)、IL-6和IL-12(先天免疫的关键标志物)。结果显示游离R837或PVP-MPDA@R837处理后细胞因子浓度显著升高。然而,游离R837组和PVP-MPDA@R837组的之间没有显著性差异,PVP-MPDA与PBS对照组之间也没有显著性差异。这些结果表明PVP-MPDA NPs没有显示增强免疫活性作用的迹象,由PVP-MPDA NPs传递的R837仍具有免疫刺激能力。 Figure 4 据报道,热诱导的癌细胞凋亡可导致肿瘤相关抗原(TAAs)和损伤相关分子模式(DAMPs)的释放,如热休克蛋白70(Hsp70)和高迁移率族蛋白-1(HMGB1)。这些物质可诱导有效的免疫应答,而免疫佐剂的引入将进一步增强其刺激程度。本研究采用Transwell实验研究了在PVP-MPDA@R837存在下,光热诱导的肿瘤细胞凋亡对BMDCs成熟的影响。如Fig.5所示,将经过各种处理的B16F10细胞放入上层,下层放DCs。分别用流式细胞仪和ELISA检测树突状细胞的成熟和细胞因子的分泌。结果表明,DCs与热损伤肿瘤细胞共培养时,共刺激因子CD80和CD86的表达水平显著上调,而PVP-MPDA@R837 NPs的加入进一步增强了这一趋势。与DCs成熟数据一致的是,激光照射肿瘤细胞孵育后,DCs分泌IL-6、IL-12和TNF-α的水平也有显著提高。PVP-MPDA@R837组上清细胞因子浓度最高。所有结果表明,通过添加光热消融的肿瘤细胞,可以进一步增强TLR激动剂对DCs成熟的影响。 Figure 5 5、PVP-MPDA NPs的淋巴结引流 淋巴结是免疫细胞的主要仓库。据报道,免疫增强剂是否能有效地导入淋巴结,将极大地影响诱导的免疫应答的质量。为了研究PVP-MPDA@R837的在体内淋巴引流情况,将颗粒皮下注射到小鼠足垫,不同时间点分离小鼠的腹股沟和腘窝淋巴结进行了研究。已知足垫是由近端的腘淋巴结引流的,转而引流向腹股沟淋巴结。立体显微镜图片(Fig.6A)清晰的显示出, PVP-MPDA NPs注射后24小时逐渐累积在同侧腘淋巴结中,并且在96小时内都停留在那里。只有一小部分在48小时后迁移到第二个引流淋巴结(同侧腹股沟淋巴结)。与之相对的是,没有在对侧淋巴结中发现这些颗粒的迹象。而且组织切片被核固红染色液染色也证实PVP-MPDA NPs存在于淋巴结中。Fig.6B明显显示PVP-MPDA NP在注射24小时后积累在被膜下淋巴窦和滤泡间区域。这些结果表明,皮下注射后,PVP-MPDA NPs在引流淋巴结内有效的积累,可最大限度地增加淋巴系统的药物暴露,通过增加DCs与T细胞相遇的机会,促进免疫应答。 Figure 6 6、体内抗肿瘤作用 分别用PBS、R837、PVP-MPDA、PVP-MPDA+NIR、PVP-MPDA@R837、PVP-MPDA@R837+NIR,对B16F10小鼠黑色素瘤模型进行肿瘤生长抑制试验,每3天免疫一次总共免疫三次(如Fig.7A)。从Fig.7B中可以看出,R837、PVP-MPDA+NIR和PVP-MPDA@R837均只有一般水平的肿瘤生长的抑制作用,与对照组相比,21天时抑制率分别为约23.4%、30.5%和41.2%,PVP-MPDA组无明显抑制作用。而PVP-MPDA@R837+NIR处理对肿瘤生长的抑制率约为66.3%。另外,PVP-MPDA@R837+NIR组小鼠的存活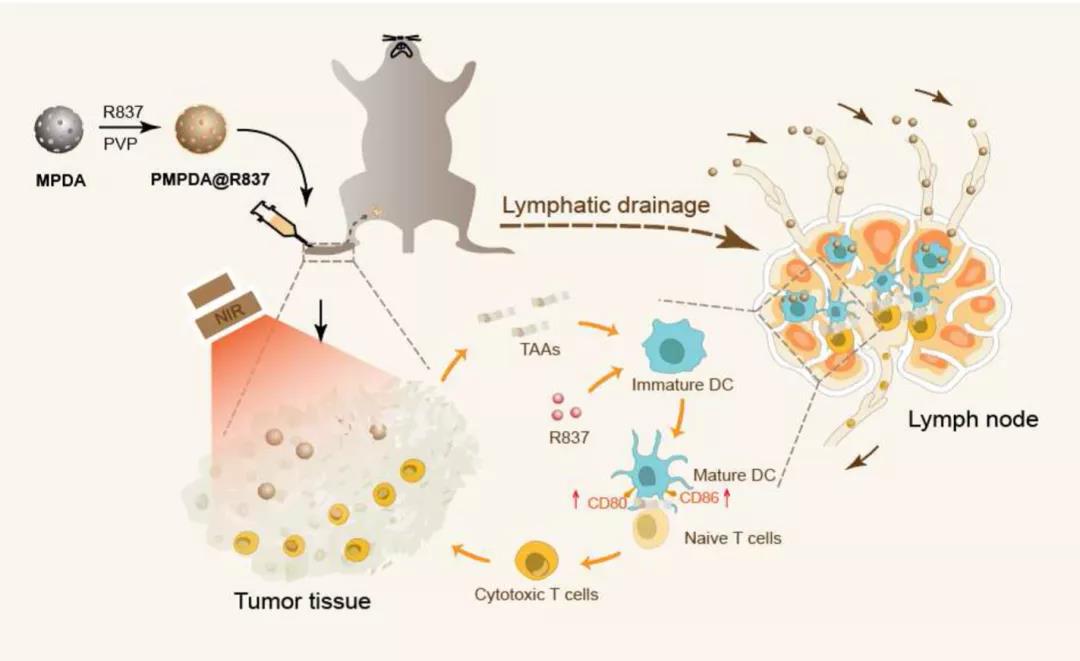

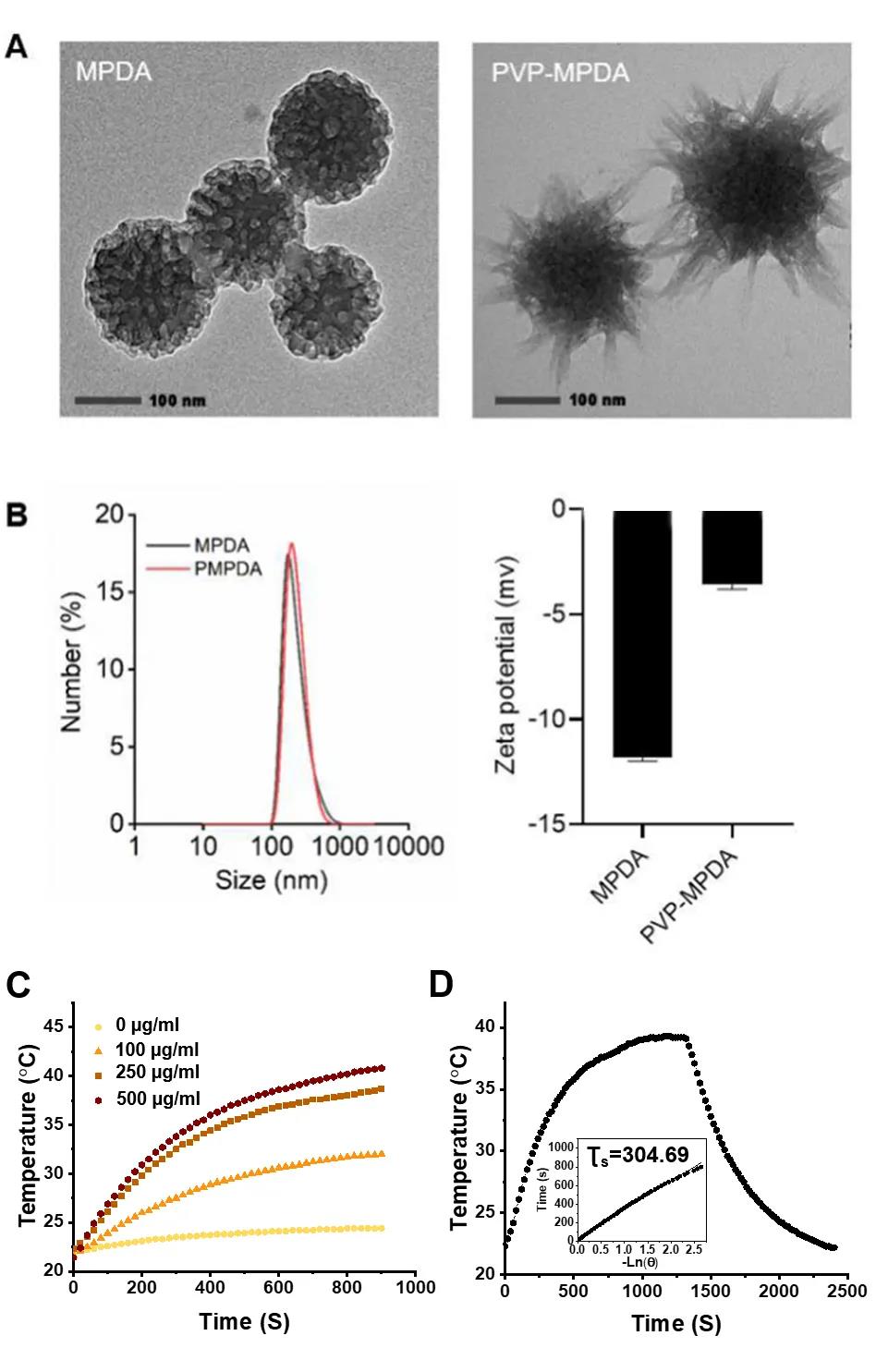

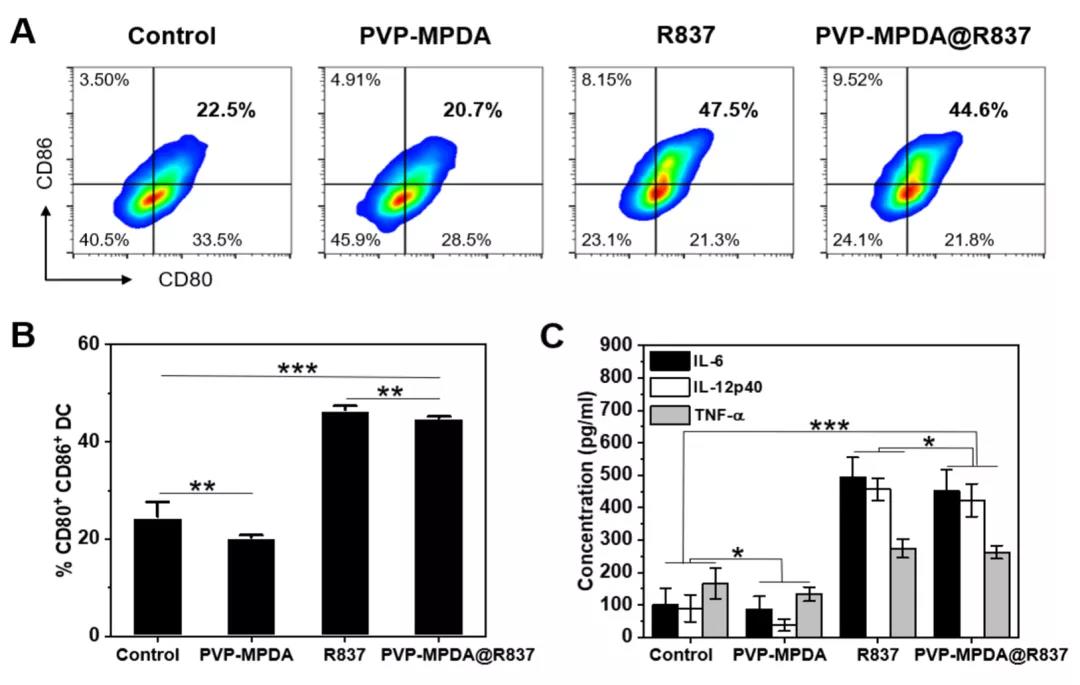
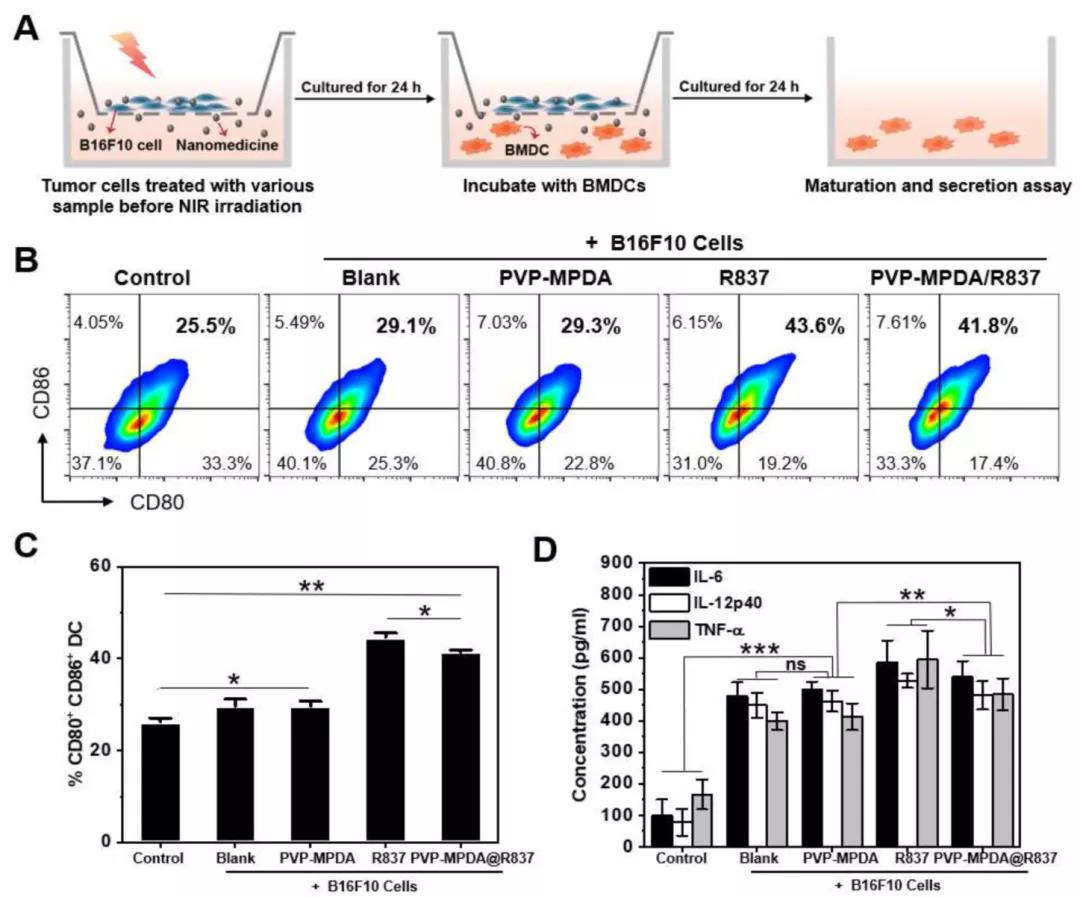
文献解读|咪喹莫特负载的介孔聚多巴胺纳米载体介导的淋巴结靶向免疫激活
作者:北京索莱宝科技有限公司 2020-09-02T00:00 (访问量:9324)
北京索莱宝科技有限公司 商家主页
地 址: 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
联系人: 索莱宝-龚思雨
电 话: 010-50973130
传 真:
Email:3193328036@qq.com
相关咨询
喜讯|索莱宝荣获专精特新“小巨人”称号 (2024-11-22T00:00 浏览数:4751)
索莱宝年终盛典,岁末回馈特惠来袭! (2024-11-22T00:00 浏览数:4651)
群贤毕至,共襄盛举|索莱宝精彩亮相2024全国植物生物学大会 (2024-11-22T00:00 浏览数:5227)
载誉而归,闪耀未来|索莱宝2024慕尼黑上海分析生化展圆满收官 (2024-11-22T00:00 浏览数:5422)
慕尼黑上海生化展,索莱宝在N4-4526等你! (2024-11-20T00:00 浏览数:7864)
新品早知道—同位素标记小分子化合物上线啦~ (2024-11-20T00:00 浏览数:7588)
抗体产品星推荐第二十二期|Anti-GNB1 Polyclonal Antibody (2024-11-20T00:00 浏览数:7500)
细胞骨架标志物 (2024-11-19T00:00 浏览数:8531)
文献解读|基因可编程细胞膜伪装纳米颗粒用于靶向联合治疗结肠直肠癌 (2024-11-19T00:00 浏览数:8436)
9月文献回顾|索莱宝产品书写科研新辉煌,共绘创新新篇章 (2024-11-18T00:00 浏览数:6407)
