题目:Near-infrared light–triggered platelet arsenal for combined photothermal-immunotherapy against cancer
期刊:science advances
影响因子:13.1159
PMID:33771861
通讯作者:马光辉
作者单位:中国科学院过程工程研究所生化工程国家重点实验室
索莱宝合作产品:
产品名称 |
产品货号 |
Mouse TNF-α ELISA KIT |
|
Mouse IL-6 ELISA KIT |
为了解决肿瘤治疗中长期存在的肿瘤渗透和靶向性问题,作者开发了一种基于抗癌血小板的仿生制剂(N+R@PLTs)将光热纳米颗粒(N)和免疫刺激剂(R)整合到血小板(PLTs)中。利用血小板的聚集特性和较高的光热容量,N+R@PLTs 通过靶向有缺陷的肿瘤血管内皮细胞,在局部热疗引起的急性血管损伤部位以正反馈聚集级联的形式聚集,起到武器库的作用,随后分泌纳米级血小板(nPLTs)将活性成分运送到肿瘤组织深处。免疫刺激剂增强了消融肿瘤释放的抗原的免疫原性,从而诱导了对攻击残留,转移性和复发性肿瘤的更强的免疫反应。通过低功率近红外光照射激活后,光热和免疫成分协同作用,在九种模拟一系列临床要求的小鼠模型中发挥了极高的治疗功效,最值得注意的是,该研究还证明了在基于人源化小鼠和患者源性肿瘤异种移植物(PDX)的复杂模型中,使用人PLT(hPLTs)的N + R @ hPLT arsenal的功效最为显著。
1.光热聚合物纳米粒子的合成
为了构建目标仿生N+R@PLT平台,作者制备了具有高光热转换效率的纳米粒子(图1A)。通过Suzuki反应[数-平均分子量(Mn)=163473;图S2A]。将这种位于疏水核中的光热共聚物和双硬脂酰磷酸乙醇胺(DSPE)-PEG的亲水聚乙二醇(PEG)段通过典型的共沉淀策略装饰表面构建了杂化纳米颗粒。所得纳米颗粒呈明确的球形,平均水动力直径约为50nm,具有明显的单分散性和表面负电荷(图1B和图S2、B和C)。此外,纳米颗粒对正常细胞的细胞毒性很小。确保了在体内给药的安全性(图S3、A和B)。
纳米颗粒具有高度一致的热稳定性和光稳定性。此外,在水介质中,这些纳米粒子产生明确的光声信号,其强度与纳米粒子浓度呈完美的线性关系(图1E),这意味着它们具有在体内引导光声成像的潜力。
2.N+R@PLTs的结构与特征
为了使光热纳米颗粒功能化,使其具有额外的PLT反应性和免疫原性,纳米颗粒被生物素修饰,而PLT膜上的CD42a被亲和素标记的抗CD42a抗体预处理。作者通过细胞切片透射电镜(TEM)成像检测PLT内部的纳米颗粒来验证CD42a分子可以促进纳米颗粒内化为PLT(图1F中的黄色箭头,与图S3C中的PLT相比)。在内化过程中,还引入了均匀分散在培养基中的免疫刺激剂R837盐酸,使得超分辨率PLT图像中同时存在N和R信号(图1G)。大约60个纳米颗粒和480万个R837盐酸盐分子被加载到每个PLT中(图S2E)。这种内化几乎没有影响PLT的大小和表面电荷,忠实地保留了光热光谱属性(图S2、C、F和图1H和I)。关于PLT生理学,红细胞与PLTs孵化后,没有观察到明显的溶血(图S3,D和E),说明其具有良好的生物相容性。此外,通过流式细胞仪(FCM)(图1J)和荧光成像策略(图S3F)评价N+R@PLTs激活后的聚集行为。而且作者发现,在二磷酸腺苷处理的N@PLT和N+R@PLT样品均显示出明显的聚集信号增加。这一发现与天然PLTs的特性反应性高度一致,说明PLTs在加载光热纳米颗粒和免疫刺激分子后仍保持其自然响应功能。
TEM图像进一步证明了这种反应性(图1K,左),显示静息态N+R@PLTs是圆形的,没有明显的伪足,而活动态N+R@PLTs变得更加树枝状和膨胀,类似于天然PLT。此外,激活导致生成丰富的nPLT,这也被TEM和扫描电镜(图1K,左插图,和图S3G)和FCM数据证实,显示高PLT标记物CD62P表达的纳米小泡信号增加(图1K,中)。在nPLTs中,观察到NDI-BT纳米颗粒(N)(图S3H)。同时,N和R的特征信号也在nPLTs中被识别出来(图1K,右),这表明这两种成分可以被nPLTs捕获,以便进一步的转运。
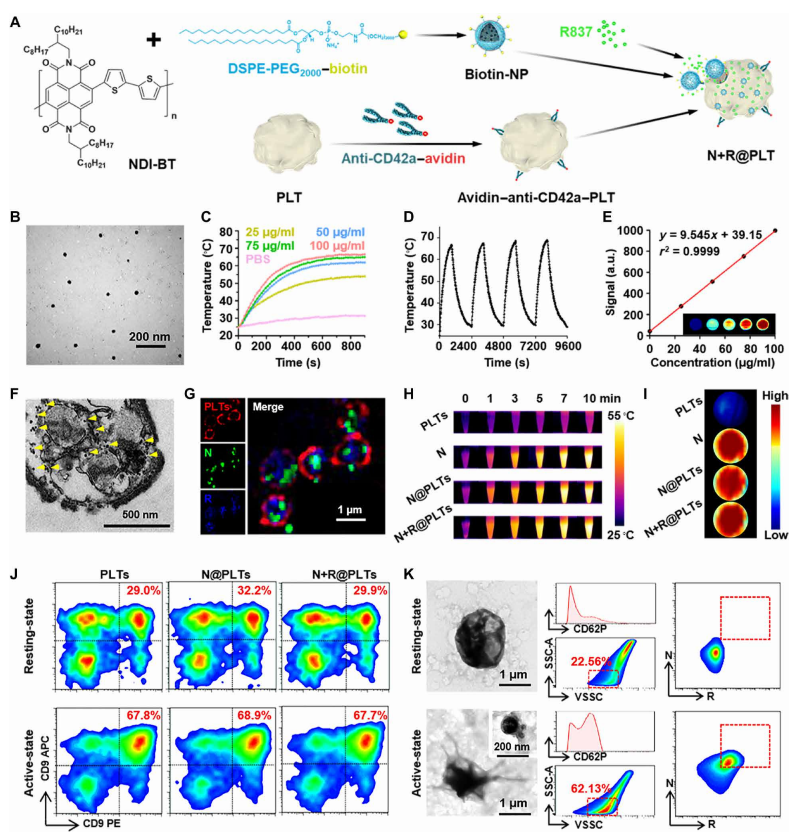
图1 N@PLTs and N+R@PLTs表征
3.体内靶向和光热性能
在成功构建了N+R@PLTs后,作者移植了4T1三阴性乳腺癌肿瘤的小鼠在体内研究了它们的命运和表现(图2A)。作者以低功率进行单次近红外照射。静脉注射后,N+R@PLTs的循环时间与天然PLTs相似,远远长于裸光热纳米颗粒(图S3,I和J)。这种相对较长的持续时间促进了N+R@PLTs在血液中作为循环哨兵的功能。
由于PLT上的粘附受体(如C型凝集素样受体2、细胞间粘附分子1和糖蛋白)和血流中的“血小板边缘”效应,N+R@PLTs对肿瘤附近的血管损伤具有天然敏感性。结果表明,少数N+R@PLTs先锋到肿瘤部位,峰值时间为1小时(图S4、A、B)。局部近红外光辐照1小时后,信号强度逐渐增加,峰值时间延长至8小时(图2B和图S4B)。利用这些纳米粒子的光声特性,通过光声成像也观察到了类似的结果。例如,经过10分钟的照射治疗后,肿瘤部位的光声信号比初始信号增加了10倍,这表明由于局部热疗引起的急性血管损伤,N+R@PLTs积累了更多的量(图2C)。为了验证,作者通过多光子共聚焦显微镜评估了N+R@PLT的命运(图2D),结果显示,最初,第一个检测到的N+R@PLTs附着在肿瘤血管壁,这归因于它们与肿瘤血管内皮细胞的亲和力。近红外照射后,可观察到肿瘤血管闭塞,提示有大量N+R@PLT聚集。
考虑到PLTs激活后分泌的nPLTs可以从肿瘤血管外渗,并进一步渗透到肿瘤深处(图S4C),因此,这些纳米囊泡中的N和R物质可以运输到肿瘤深层组织中,这可以通过免疫组化(IHC)肿瘤切片中N和R信号的共定位来证实(图2E)。这种自我强化和子代在肿瘤周围产生了强大的武器,除了提供一种机制来克服对肿瘤内浸润的抵抗,这阻碍了传统的细胞介导的传递系统。扩张的攻击区域导致了实体肿瘤的强效热疗(图2F)。与自然PLT组的稳定温度相比,N(L)组由于靶向性较差,在10min内温度出现了适度上升(至44℃)。值得注意的是,作者观察到 N+R@PLT组,温度迅速增加到56°C(图S3K),导致热休克蛋白(HSP)在肿瘤组织中表达最高(图2G)。
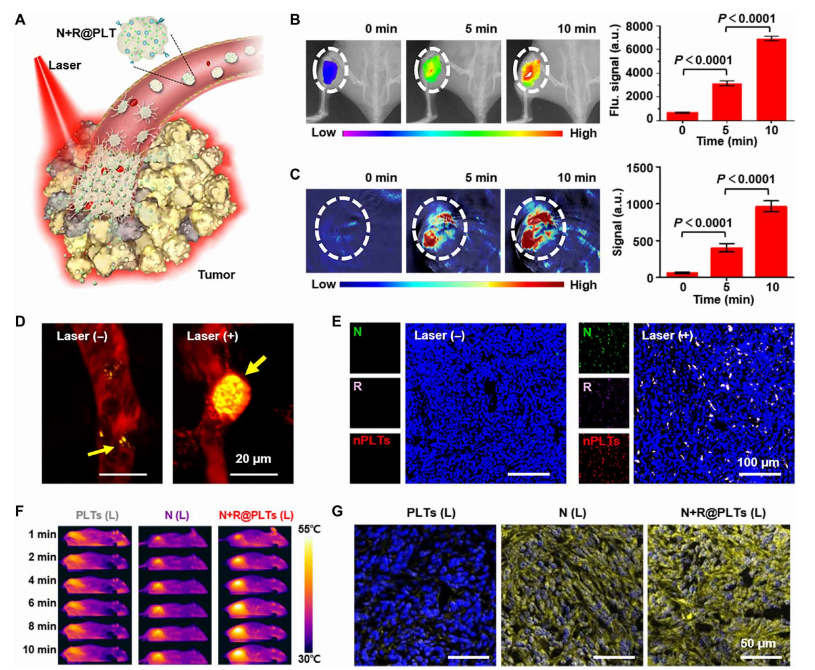
图2 N+R@PLT在体内的聚集和光热效应
4.光热治疗后的免疫反应
作者还评估了PTT引起的免疫反应(图3A)。考虑到细胞因子作为免疫反应指标的效用,监测了白细胞介素-6(IL-6)和肿瘤坏死因子-ɑ(TNF-ɑ)的血清水平(图3B)。N(L)处理对细胞因子产生的影响很小,因为N在肿瘤部位的积累较低,随后的光热效应较低。由于激光照射诱导的PLT聚集改善了肿瘤的积聚(图S4、D和E),随后光热效应增强(图2F和图S3K),N@PLTs(L)组的这种效应得到了改善。在N+R@PLT组,无激光照射排除局部热疗效应,细胞因子中度升高仅归因于负荷R。这两个方面的协同作用下,N+R@PLTs(L)组IL-6和TNF-ɑ的水平进一步增加,但仍在正常范围内,表明引发了安全有效的免疫反应。
作者选择血清细胞因子水平在第3天达到峰值这个时间点对肿瘤引流淋巴结(TLN)进行详细研究,TLN位于肿瘤的直接下游,可以从免疫抑制重构为免疫刺激,用于抗癌免疫治疗。如图3C所示,在对照组中几乎未检测到肿瘤抗原(TA)的征象,而在N-based PTT[N(L)]组中仅发现少量信号。相比之下,PTT单方式治疗[N@PLTs(L)]或免疫刺激(N+R@PLTs)可在树突状细胞(DCs)中产生更多分散的TA信号。联合处理[N+R@PLTs(L)],大量暴露的TA被转运到TLN,增加了树突状细胞的摄取,伴随着最高水平的树突状细胞成熟(图3D中由CD80和CD86表示)。相应地,通过Ki67染色,作者检测到整个TLN中存在大量的免疫细胞增殖(图3E)。CFSE进一步定量显示,N+R@PLTs(L)组中有84.9%的CD8+T细胞增殖,而其他组的增殖效率在40%以下(图3F)。结果表明,在N+R@PLTs(L)组中,更多来自免疫刺激TLN的CD8+T细胞浸润到肿瘤中(图3G),表明其优越的免疫治疗效果补充了PTT的性能。
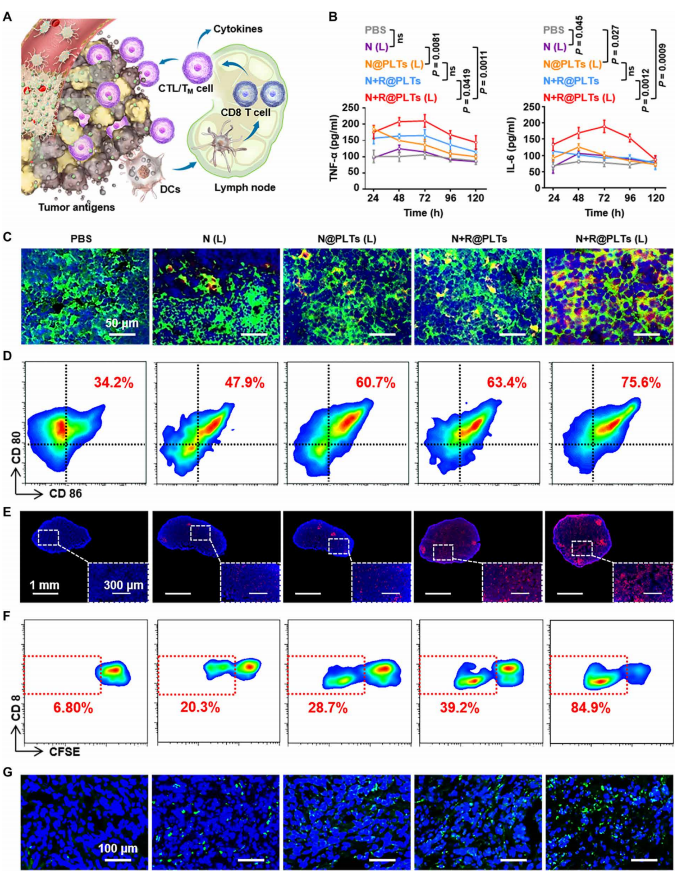
图3 不同处理组的体内免疫反应效果
5.对各种小鼠肿瘤模型的治疗作用
作者系统地评估了PLTs在不同小鼠模型中的治疗效果,以确定这种治疗是否能够适应广泛的临床抗癌需求。安全性评估研究表明,在荷瘤小鼠或非荷瘤小鼠的器官、血清、凝血能力、温度和体重中观察到很少异常(图S6和S7),从而证实了作者制备的仿生PLT制剂的安全性。
为了进一步证实工程化PLTs对光热抗癌疗法的优越性,作者将一种典型的光热剂Au纳米棒(A)纳入了比较,该试剂被PLT膜包裹(A@PM)或根据先前报道的基于PLT的配方装载到整个PLT(A+R@PLTs)中(图S8)。A+R@PM、A+R@PM(L)、A+R@PLTs(L)三组均加入相同的佐剂盐酸R837,以匹配联合免疫治疗(图S8、A、B)。A+R@PM(L)和A+R@PLTs(L)的治疗效果均显著低于N+R@PLTs(L)(图S8,C至E)。更大的成功在于对N+R@PLT-based PTT配方[N+R@PLTs(L)组]进行了以下改进:首先,光热材料NDI-BT纳米颗粒表现出更高的光热转换效率(图S8,F to H)。因此,与A+R@PM(L)组和A+R@PLTs(L)组相比,单次低功率近红外照射可有效诱导N+R@PLTs(L)组的局部热疗(图S8I)。更重要的是,整个PLT方案显示在自然的PLT激活下,肿瘤血管高效靶向聚集级联,并以反馈依赖的方式不断累积到局部热疗引起的急性血管损伤部位。此外,与基于粘附的策略相比,肿瘤部位PLT库分泌的nPLT“后代”表现出了强穿透深层组织的能力。相比之下,A+R@PM(L)组的包膜缺乏自我强化和nPLT产生的能力,而仅通过粘附策略靶向肿瘤血管(图S8J)。
为了模拟更先进的转移过程,作者建立了一个血行转移模型进行进一步的研究。通常情况下,移植了4T1肿瘤的小鼠在第7天接受不同PLT配方的单一治疗,然后在第8天再次静脉注射4T1细胞(图4F)。由于这些4T1细胞预先表达了荧光素酶(标记为Luc-4T1),通过检测生物发光可以同时监测原发肿瘤和肺转移的发展(图4,G和H)。光热[N@PLTs(L)]和免疫(N+R@PLTs)单独治疗组对原发性肿瘤和肺转移信号的抑制均有中等效果。相比之下,N+R@PLTs(L)联合治疗导致原发部位和转移部位的生物发光信号消失(图S9A),表明肿瘤细胞在全身被完全根除。相应的,N+R@PLTs(L)治疗组在100天后的存活率为100%,而其他治疗组的小鼠均在4~7周内死亡(图4I)。
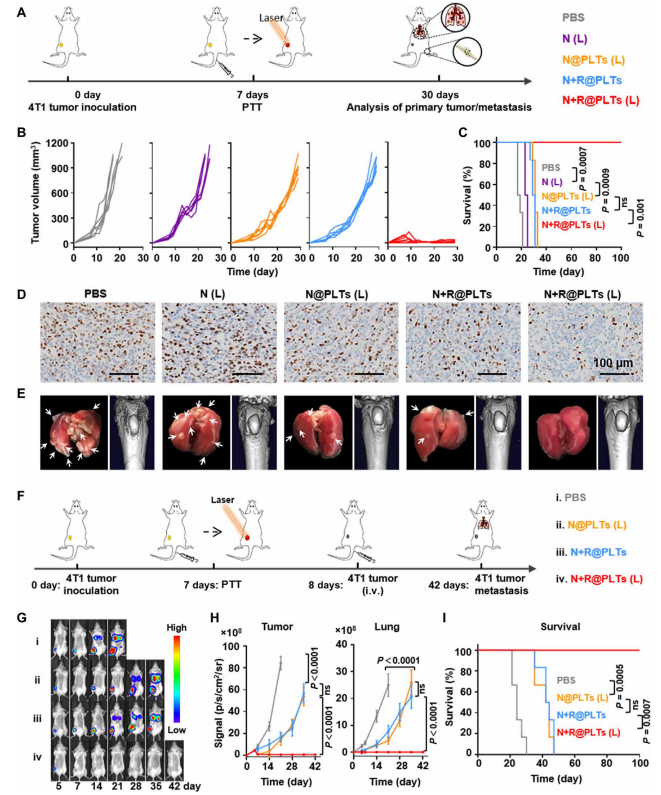
图4 基于N+R@PLT光热免疫联合治疗4T1
原发肿瘤及血行转移
为了进一步探索在物理远端肿瘤中激活光热-免疫协同作用的潜力,作者继续使用双肿瘤模型(图5A),其中单侧肿瘤接受了不同PLT配方的单一治疗。历史上,这种双肿瘤模型为传统的光热治疗策略提出了一个挑战性的障碍,因为这些治疗通常需要直接获取近红外源来进行有效的治疗。作者发现,在低功率的单一近红外照射条件下,N@PLTs(L)治疗仅在原发肿瘤和远端肿瘤部位诱导了中度抑制肿瘤发展的作用(图5B),这与在N+R@PLT免疫刺激小鼠中观察到的相似。相应地,这两组小鼠在大约第40天迅速死亡。相比之下,N+R@PLTs(L)组原发肿瘤和远端肿瘤均被完全抑制,所有小鼠在第100天后仍然存活,这表明协同作用必须达到有效的治疗效果(图5C)。考虑到免疫反应通常与一种典型的持久记忆效应相关,这对良好的癌症预后至关重要,继续评估PLTs诱导的长期抗癌免疫(图5D)。作为对照,用4T1细胞攻击健康小鼠可诱导肿瘤快速发展,并在随后的4周内逐渐死亡(图5E)。当小鼠被移植4T1肿瘤时,接受N+R@PLTs(L)单次治疗后,作者观察到脾中效应记忆T细胞显著增加,甚至在50天后(图5F)。在建立长期免疫记忆后,随后用4T1肿瘤细胞再次处理后,对侧腹的肿瘤形成完全抑制,100天存活率为100%(图5G)。
手术切除后残留的肿瘤细胞经常导致肿瘤复发,是临床常见的问题。为了解决这个问题,作者接下来研究了PLT平台在预防术后复发方面的适用性。为此,作者通过手术切除大部分原发肿瘤建立了复发模型(图5H)。相应的,手术后治疗组间剩余的Luc-4T1细胞信号强度几乎相等。与前期实验一致,PBS组的生物发光信号在随后的2周内继续扩散,恶性肿瘤复发,患者的生存率为0%(图5I)。然而,N+R@PLTs(L)方案在手术不完全切除后立即实施,残余生物发光信号在1周内完全消失(图S9B)。相应的,所有小鼠都保持无肿瘤,在长期(100天)观察期间存活率为100%。除4T1乳腺癌外,作者还在CT26结直肠癌、B16黑色素瘤、Lewis肺癌(LLC)和肝癌-22(H22)模型中验证了这种有效的抗复发作用,从而验证了基于PLT仿生平台的抗癌功效的普遍性(图5, J 到 M)。
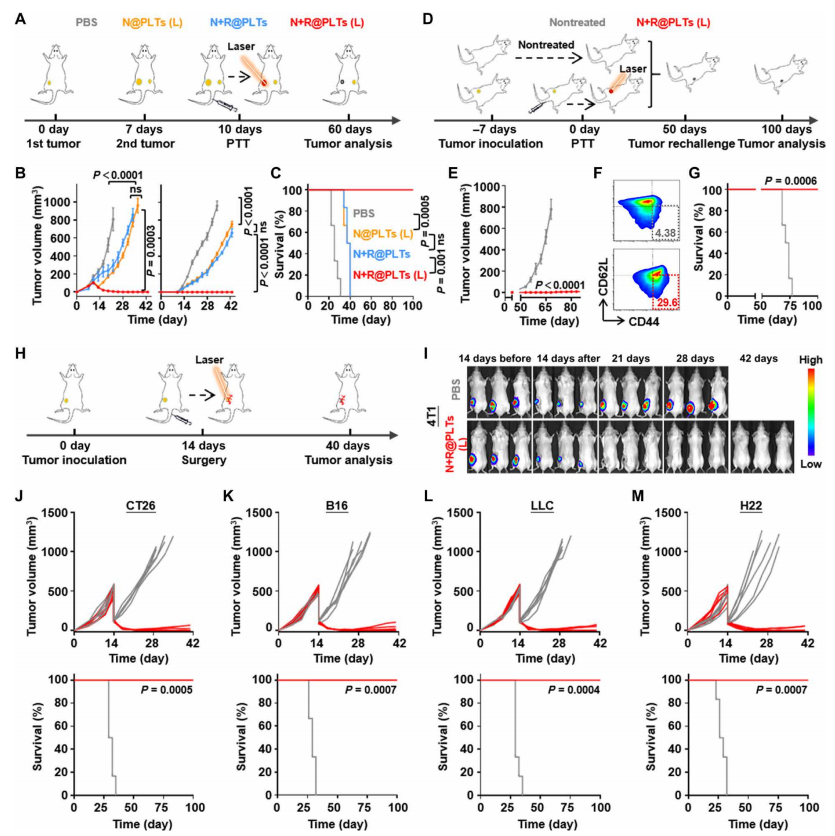
图5 基于N+R@PLT光热免疫联合治疗
多种肿瘤和免疫反应效果评价
6.构建基于hPLT的制剂并在复杂的人源化PDX模型中验证疗效
为了进一步证实作者的PLT平台
北京索莱宝科技有限公司 商家主页
地 址: 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
联系人: 索莱宝-龚思雨
电 话: 010-50973130
传 真:
Email:3193328036@qq.com
相关咨询
喜讯|索莱宝荣获专精特新“小巨人”称号 (2024-11-22T00:00 浏览数:4743)
索莱宝年终盛典,岁末回馈特惠来袭! (2024-11-22T00:00 浏览数:4644)
群贤毕至,共襄盛举|索莱宝精彩亮相2024全国植物生物学大会 (2024-11-22T00:00 浏览数:5214)
载誉而归,闪耀未来|索莱宝2024慕尼黑上海分析生化展圆满收官 (2024-11-22T00:00 浏览数:5408)
慕尼黑上海生化展,索莱宝在N4-4526等你! (2024-11-20T00:00 浏览数:7848)
新品早知道—同位素标记小分子化合物上线啦~ (2024-11-20T00:00 浏览数:7565)
抗体产品星推荐第二十二期|Anti-GNB1 Polyclonal Antibody (2024-11-20T00:00 浏览数:7484)
细胞骨架标志物 (2024-11-19T00:00 浏览数:8517)
文献解读|基因可编程细胞膜伪装纳米颗粒用于靶向联合治疗结肠直肠癌 (2024-11-19T00:00 浏览数:8423)
9月文献回顾|索莱宝产品书写科研新辉煌,共绘创新新篇章 (2024-11-18T00:00 浏览数:6396)
